- 上海中申国际贸易有限公司,20年外贸进出口代理服务经验。
- 服务热线:139 1787 2118
近期,中国海关和国家药品监督管理局对进口医疗器械的监管证件联网核查的申报要求和校验规则进行了优化升级。这些改变旨在进一步优化口岸营商环境,促进跨境贸易便利化。
一、产品定义和分类
医疗器械是直接或间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或相关的物品,包括所需要的计算机软件。其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用。药监部门对医疗器械按照目录实施管理,包括22个子目录、206个一级产品类别、1157个二级产品类别以及6609个典型产品名称举例。
二、证书要求
进口的医疗器械应当是依照《医疗器械监督管理条例》第二章的规定已注册或者已备案的医疗器械。对第一类医疗器械实行产品备案管理,对第二类、第三类医疗器械实行注册管理。第一类医疗器械,许可证类别应为"629-第一类医疗器械备案凭证”;第二类或第三类医疗器械,许可证类别应为"612-医疗器械注册证”。

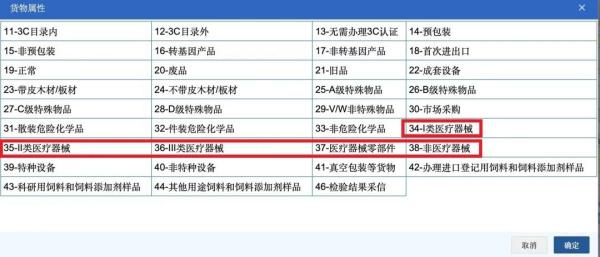
三、货物属性
货物属性分为医疗器械、医疗器械零部件、非医疗器械三类。医疗器械包括符合《医疗器械分类目录》定义、描述的范围的产品。医疗器械零部件包括在《第一类医疗器械产品目录》或《医疗器械分类目录》定义、描述的范围内,提供给医疗器械生产企业作为生产资料生产医疗器械的零部件或医疗器械注册证中"结构及组成”栏内所载明的组合部件。非医疗器械则包括产品原理、结构、功能等与医疗器械类似,但不属于《医疗器械监督管理条例》有关医疗器械定义的产品。
四、申报示例:
以X射线管为例,介绍四种常见的申报情况:
1、工业用X射线管:货物属性填报为"38-非医疗器械”,无需录入"612 -医疗器械注册证”。
2、用于原注册产品的医用X射线管:如果是以更换耗材、售后服务、维修等为目的,并在原注册产品医疗器械注册证中"结构及组成”栏内载明的医用X射线管,货物属性填报为"37-医疗器械零部件”,需要录入原注册产品的"612-医疗器械注册证”。
3、用于办理医疗器械注册检验的医用X射线管:如果是需送第三方机构检测或进行临床试验的医用X射线管,货物属性填报为"35-Ⅱ类医疗器械”,需要录入"612-医疗器械注册证”,"许可证编号”填报为"612检验检测样品”。
4、暂时出境后复运进境的医用X射线管:货物属性填报为"35-Ⅱ类医疗器械”,需要录入"612-医疗器械注册证”,"许可证编号”填报为"612暂时出口复进口”。
五、注意事项:
1、货物属性填报为"34-I 类医疗器械”的,不得同时填报其他类别;同时,必须录入"629-第一类医疗器械备案凭证”。
2、货物属性填报为"35-Ⅱ类医疗器械”的,不得同时填报其他类别;同时,必须录入"612-医疗器械注册证”。
3、货物属性填报为"36-Ⅲ类医疗器械”的,不得同时填报其他类别;同时,必须录入"612-医疗器械注册证”。
4、货物属性填报为"37-医疗器械零部件”的,不得同时填报其他类别;同时,可视情况录入"612-医疗器械注册证”或"629-第一类医疗器械备案凭证”。
5、货物属性填报为"38-非医疗器械”的,不得同时填报其他类别;同时,不得录入"612 口医疗器械注册证”或"629-第一类医疗器械备案凭证”。
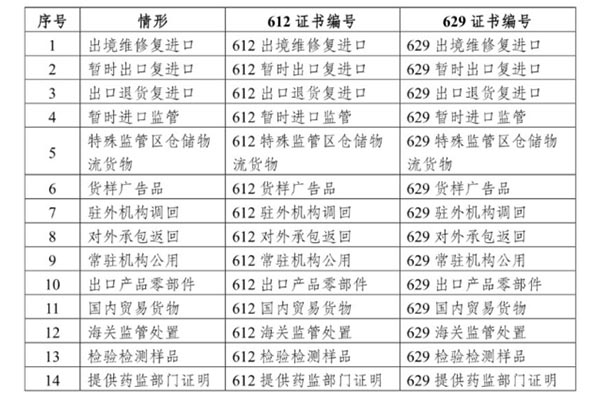
结合进口贸易实际,海关对非必须提供医疗器械注册证/第一类医疗器械备案凭证的有关情形进行了梳理及分类,共计14种。
结合进口贸易实际,海关对非必须提供医疗器械注册证/第一类医疗器械备案凭证的有关情形进行了梳理及分类,共计14种。进口医疗器械产品未取得"医疗器械注册证”,但属于有关情形的,"许可证编号”填写"612XXXXXX”;未取得"第一类医疗器械备案凭证”,但是属于有关情形的,"许可证编号”填写"629XXXXXX”。
以上内容来源于海关发布,中申国贸作为一站式进出口代理服务商,可以为各行业提供定制化的进出口解决方案。如您需要外贸进出口代理服务,欢迎联系我司咨询业务,咨询热线139-1787-2118。
相关推荐
联系我们
邮箱:service@sh-zhongshen.com
微信联系

© 2024. All Rights Reserved. 沪ICP备2023007705号-2  沪公网安备31011502009912号
沪公网安备31011502009912号